今天,《科学》杂志官网上刊登了一则新闻:糖尿病可以像疯牛病一样传播吗?[1]啥?疯牛病?这是说糖尿病是一种“传染病”?也太吓人了吧!

Claudio Soto教授
奇点糕再定睛一看,科学家们的意思好像不是如此“浅薄”,这个研究是由德克萨斯大学健康科学中心McGovern医学院的Claudio Soto教授团队完成的,发表在《Journal of Experimental Medicine》杂志上[2]。
过去的研究发现,超过90%的II型糖尿病患者胰岛内都有一种错误折叠的蛋白积聚,这种蛋白被命名为“胰岛淀粉样多肽(IAPP)”[3]。之后的多个研究表明,IAPP基因的突变以及IAPP的错误折叠和积聚与胰岛β细胞数量和功能的丧失、高血糖还有糖尿病发病风险增加有关[4,5,6],但是其中的因果关系一直没有被确定。而这次,Soto教授发现,IAPP像一粒“种子”一样,当它从II型糖尿病小鼠中转移入其他小鼠体内后,会“生根发芽”,最终使其他小鼠也患上II型糖尿病!Soto教授认为,这与引发疯牛病的朊病毒有着异曲同工之处,当牛吃了被感染的肉或骨髓制成的饲料或是人吃了被感染的牛肉后,朊病毒就会被“传递”,潜伏在体内增殖,感染牛或是人[1]。
胰岛立体结构
所以说,这个研究并不是提醒我们II型糖尿病一定会以食物摄入或是血液传播的方式传播,而是意味着,IAPP可能作为糖尿病的“源头”,在细胞与细胞、胰岛与胰岛之间传播,导致疾病的发生和发展。这是一个新的致病途径,也可能会为II型糖尿病的研究打开一个全新的领域。
在研究中,研究人员首先将人的IAPP基因转入小鼠体内,让小鼠可以过表达人的IAPP(hIAPP)。研究人员观察到IAPP的积累一开始很少,而且只在细胞内,但后来积累越来越多,也渐渐发展到了细胞外。到了12月龄的时候,这些小鼠出现了胰岛病理变化和一系列的糖尿病症状:大量淀粉样物质的积聚、严重的高血糖和胰岛素分泌的减少。
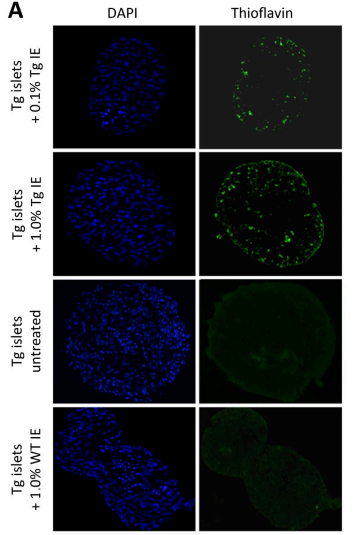
由上至下依次为0.1%的糖尿病小鼠胰岛提取物、1%的糖尿病小鼠胰岛提取物、不添加任何物质以及1%的普通小鼠胰岛提取物。DAPI染色观察到的为细胞,Thioflavin染色的荧光部分为IPPA积聚
研究人员将这些糖尿病小鼠的胰岛分离出来,接下来他们找了3周龄的转入了hIAPP基因的小鼠,这些年轻小鼠并不存在IAPP的积聚,研究人员同样分离了它们的胰岛,将其与1%或是0.1%的糖尿病小鼠的胰岛提取物共同培养7天。7天后,研究人员发现这些小鼠都出现了IAPP的积聚,而没有加入任何提取物或是加入了普通小鼠胰岛提取物的则没有出现积聚。
为了更好的模拟人类的情况,研究人员从非II型糖尿病患者的尸体中获取了他们的胰岛,这些人的IAPP表达量正常,没有错误折叠和积聚,当它们与糖尿病小鼠的胰岛提取物共培养后也出现了IAPP的积聚!而如果用特异性IAPP抗体处理糖尿病小鼠的胰岛,使IAPP被免疫耗竭后,再进行共同培养就不会出现积聚现象。
有了这些体外实验“打底”,研究人员接下来进行了小鼠的体内实验,希望能验证小鼠确实会出现符合II型糖尿病的相关症状。他们给3周龄的hIAPP转基因小鼠腹腔注射了100 µl,10%的糖尿病小鼠胰岛提取物,分别在第5、8、10和20周龄时观察它们IAPP积聚的情况。
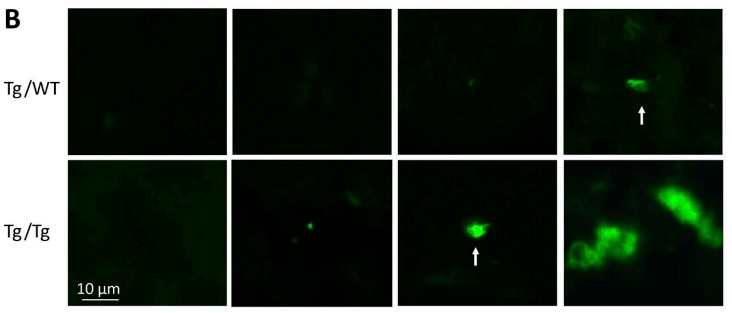
从左至右为第5、8、10和20周龄时注射糖尿病小鼠胰岛提取物(Tg/Tg)和注射普通小鼠胰岛提取物(Tg/WT)IAPP积聚(绿色荧光)的对比
结果显示,从第8周龄开始,小鼠胰岛内有了极少量的IAPP,随着时间推移逐渐增加,到了第20周龄时,胰岛内的IAPP已经是广泛存在,呈现典型的II性糖尿病发病的堆积状态。与注射普通小鼠胰岛提取物相比,糖尿病小鼠的胰岛提取物极大地加速了IAPP的积聚。
那么小鼠们的“外在表现”又如何呢?研究人员观察到,在第8周开始出现IAPP积聚后,小鼠的空腹血糖水平就开始了“超标之路”,第20周时最高的更是超过了350mg/dl(空腹血糖超过126 mg/dl就可以判断为糖尿病了)。这些小鼠中超过70%都患上了高血糖症(血糖水平>250mg/dl)。在糖耐量试验中,小鼠接受了1g/kg体重剂量的葡萄糖注射。不出意外的,这些小鼠表现也很糟糕,它们的血糖飙升到了未注射时的2.5倍,而在2个小时的时间内也未能恢复到原来的水平,这表明它们的胰岛素分泌确实受到了影响。

A:注射糖尿病小鼠胰岛提取物(黑)、注射普通小鼠胰岛提取物(白)和普通小鼠(灰)随时间(周)空腹血糖的变化
接下来,研究人员还对小鼠的胰岛进行了形态学检查。它们发现小鼠的胰岛形态发生了改变,由于β细胞的大量死亡,α和δ细胞大量增加。与注射了普通小鼠胰岛提取物的转基因小鼠相比,β细胞在胰岛中占据的面积减少了至少60%,与普通小鼠相比更是超过75%!
这些实验结果提示我们,在有合适的“土壤”条件下,播种一颗IAPP的“种子”,它就会逐渐长大、扩散,最终导致β细胞的丧失和一系列糖尿病症状的出现。
虽然已经观察到了这些让人感到震惊的结果,但是研究人员还是认为不够“严谨”,因为给小鼠注射的胰岛提取物中还含有除了IAPP外的其他组分,万一它们也会对小鼠的胰岛造成影响呢?于是研究人员使用合成的纯IAPP再次进行了体外和体内实验。
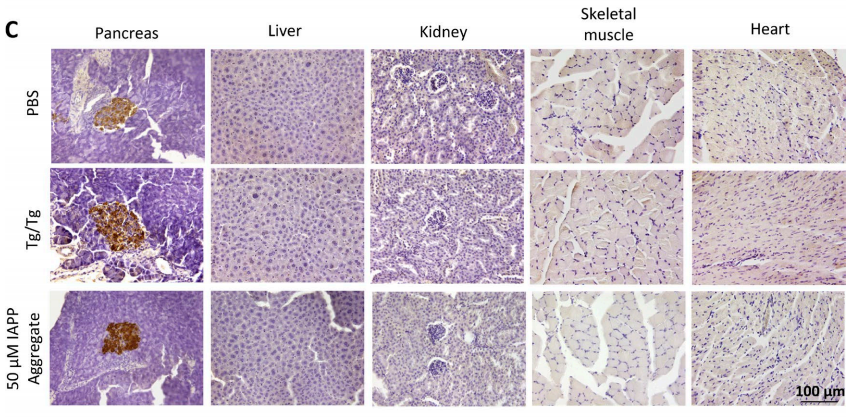
小鼠器官切片染色中可以看到只有胰脏(最左)中有IAPP的积聚,肝、肾、骨骼肌和心脏中都不存在
几乎没有什么悬念,他们得到了和前面两组实验相似的结果。而且研究人员还使用从阿尔茨海默氏病患者大脑中取得的Tau蛋白和细菌来源的淀粉样蛋白microcin进行了实验,与IAPP相比,这两种蛋白都不会让小鼠发展为糖尿病。并且,通过排查,除了胰脏,小鼠的心、肝、肾和骨骼肌中都不会有IAPP的积聚,这说明,IAPP对胰岛的伤害是具有“特异性”的。
研究人员表示,他们的研究提供了IAPP错误折叠并积聚在II型糖尿病中的重要作用,因为在没有其他影响因素,如高脂饮食、肥胖或胰岛素信号传导中断的情况下,它的存在足以诱导糖尿病的发生[7]。
此外,他们认为这个研究成果的重要性不仅仅局限于了解疾病的起源和进程,还为防止疾病的发展和治疗提供了新的靶点,例如防止IAPP积聚或是清除IAPP积聚物的药物可能会阻止所在胰岛的损伤,也防止积聚物扩散到其它胰岛,帮助控制、稳定患者的病情。
Soto教授透露,下一步他们想要研究糖尿病是否可以通过已知的朊病毒传播方式,如输血或是器官移植来传播[1],尽管在器官移植后发生糖尿病[8]已经有过一些报道了,但是是否是通过IAPP却是完全未知的。而且他表示,如果资金支持允许的话,他们还希望能继续进行非人类的灵长类动物实验,这对于将这一原理投射到人体内会起到重要的作用。
参考资料:[1] http://www.sciencemag.org/news/2017/08/could-diabetes-spread-mad-cow-disease
[2] Inductionof IAPP amyloid deposition and associated diabetic abnormalities by aprion-like mechanism. Journal of Experimental Medicine, 2017, DOI: 10.1084/jem.20161134
[3] Westermark, P. 1972. Quantitative studies on amyloid in the islets of Langerhans. Ups. J. Med. Sci. 77:91–94.
[4] Novials, A., I. Rojas, R. Casamitjana, E.F. Usac, and R. Gomis. 2001. A novel mutation in islet amyloid polypeptide (IAPP) gene promoter is associated with type II diabetes mellitus. Diabetologia. 44:1064–1065.
[5] Janson, J., W.C. Soeller, P.C. Roche, R.T. Nelson, A.J. Torchia, D.K. Kreutter, and P.C. Butler. 1996. Spontaneous diabetes mellitus in transgenic mice expressing human islet amyloid polypeptide. Proc. Natl. Acad. Sci. USA. 93:7283–7288.
[6] Clark, A., C.A. Wells, I.D. Buley, J.K. Cruickshank, R.I. Vanhegan, D.R. Matthews, G.J. Cooper, R.R. Holman, and R.C. Turner. 1988. Islet amyloid, increased A-cells, reduced B-cells and exocrine fibrosis: quantitative changes in the pancreas in type 2 diabetes. Diabetes Res. 9:151–159.
[7] http://www.genengnews.com/gen-news-highlights/transmission-of-diabetes-prion-like-aggregates-triggers-disease-symptoms/81254744
[8] Marchetti P. New-onset diabetes after transplantation[J]. The Journal of heart and lung transplantation, 2004, 23(5): S194-S201.
| 序号 | 最新资讯 | 浏览次数 | 作者 | 发布时间 |
| 1 | 不可思议!II型糖尿病或起源于特殊蛋白的堆积,可以像朊病毒一样传播 | 3590 | 市场部 | 2017-08-07 |
| 2 | 国内四篇Cell齐发:中国生命科学正阔步前进 | 1361 | 市场部 | 2017-07-30 |
| 3 | 左建儒组Mol Cell揭示蛋白质翻译后修饰互作调控植物胁迫反应的新机制 | 1749 | 市场部 | 2017-07-30 |