癌症的研究和治疗一直是世界性的难题,近年来随着生活和环境的问题,癌症的发病率逐年升高。2016年,国家癌症中心赫捷院士和全国肿瘤登记中心陈万青教授等调查统计结果估计,中国2015年估计有429.2万例癌症新发病例,281.4万例癌症死亡[1],平均每分钟就有8人确诊癌症,每分钟5人死于癌症。

近几年肿瘤免疫治疗接连创造癌症“临床治愈”的奇迹,成为抗争癌症的“强心剂”。而其中备受大家关注并广泛应用于临床的是免疫检查点抑制剂PD-1/PD-L1免疫疗法[2,3]。
PD-1/PD-L1相当于机体的“接头暗号”,PD-1是活化免疫T细胞的“天王盖地虎”,PD-L1是抗原呈递细胞的“宝塔镇河妖”,暗号一旦对接成功,免疫T细胞就认为是“自己人”而不发生攻击。这本来是人类进化中的“神来之笔”,但是狡诈的癌症细胞破解了机体“暗语”,遇到免疫T细胞就喊“宝塔镇河妖”,让免疫T细胞误认为其是“自己人”。
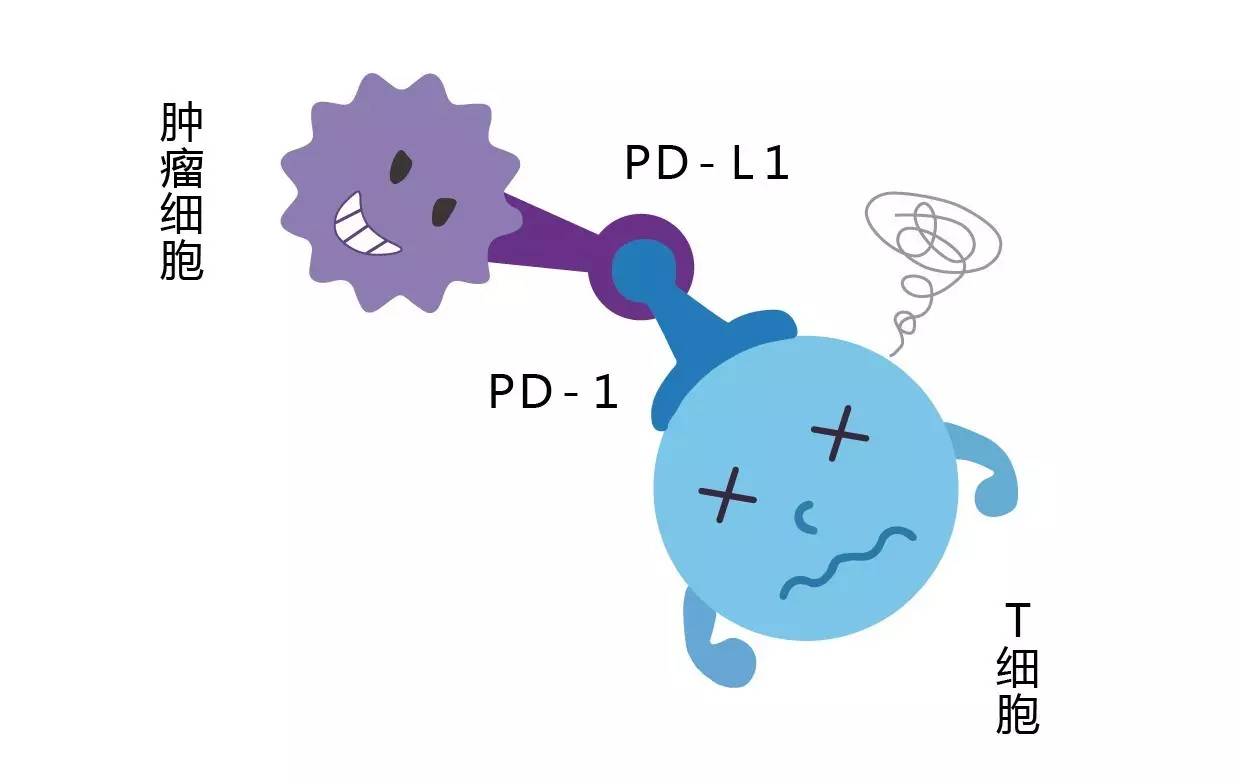
然而,PD-1/PD-L1免疫检查点阻断在大部分癌症患者中是没有持续的临床治疗效果的[4],因此研究是否有其他药物与PD-1抑制剂联合使用的免疫治疗策略已经成为一种趋势。
来自博德研究所的John G. Doench教授和W. Nicholas Haining教授应用CRISPR/Cas9技术,在小鼠移植肿瘤模型中筛选抵抗和敏感于肿瘤免疫治疗的基因,找到肿瘤免疫治疗的新靶点Ptpn2。这一发现于7月19日发表在Nature杂志上[5]。

John G. Doench W. Nicholas Haining
1. 体内筛选策略发现癌细胞逃避免疫治疗的已知基因和潜在机制
为了筛选到导致癌症逃避免疫治疗的可能基因,作者首先设计了靶向2,368个基因的9,872个gRNA,包装成慢病毒,感染过表达casp蛋白的黑色素瘤细胞;然后把这些细胞移植到Tcra−/−小鼠(缺失CD4+和CD8+细胞)或者野生型小鼠体内,野生型小鼠然后给予GVAX或者GVAX联合PD-1抗体处理;最后对各组测序进行基因比对,找到可能的靶基因(图1a,1b)。筛选结果发现2个已知基因PD-L1和CD47(图1c,1d),证明这个体系是有效的。
进一步作者分析了在免疫治疗组明显富集的gRNA靶向敲除基因,这些基因可能是导致肿瘤细胞抵抗免疫治疗的潜在机制。结果提示干扰素通路对于肿瘤免疫治疗是非常重要的(图1e-1h)。
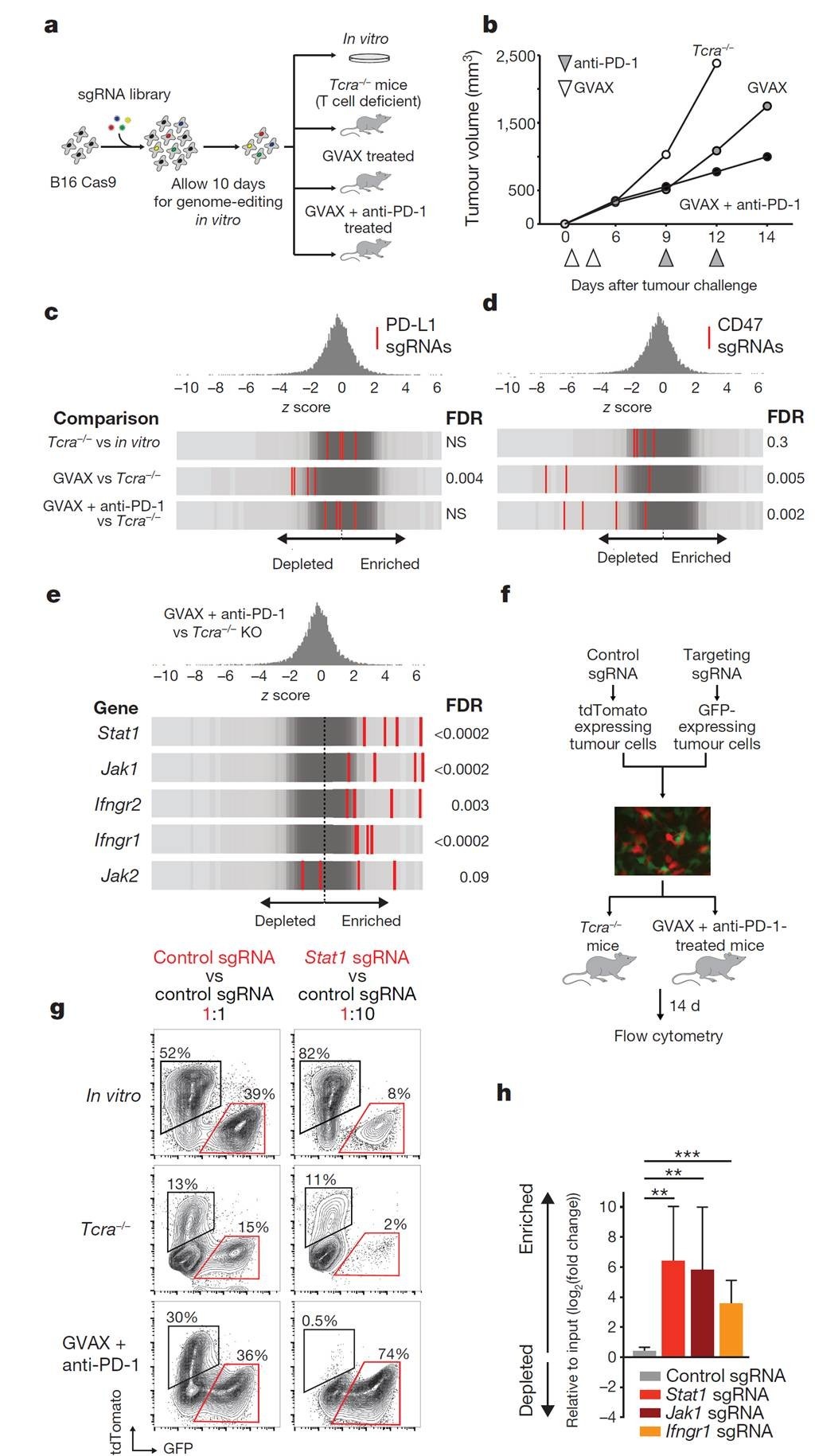
图1 体内筛选策略发现癌细胞逃避免疫治疗的已知基因和潜在机制
2. 筛选肿瘤免疫治疗的潜在靶基因
作者分析在免疫治疗组明显缺失的gRNA靶向敲除基因,这些基因可能是促进免疫治疗的潜在基因,结果发现基因主要分布在1.TNF/NF-kB通路;2. 抗原呈递系统;3. 激酶抑制信号系统;4. 泛素-蛋白酶体通路(图2a)。四个通路中分布筛选到四个差异最明显的基因Ptpn2,H2-T23,Ripk1,Stub1(图2b-2e)。
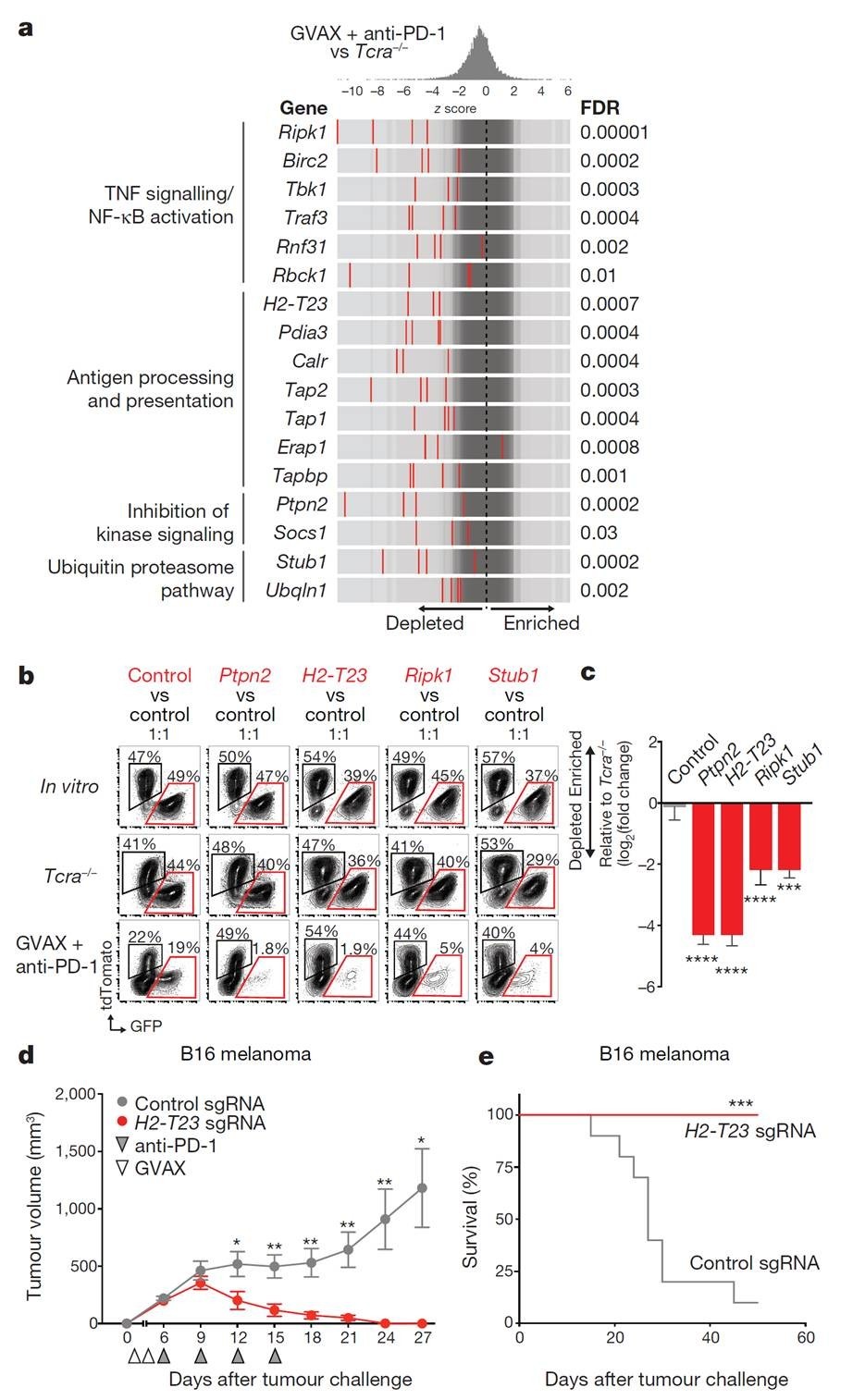
图2 筛选肿瘤免疫治疗的潜在靶基因
3. Ptpn2基因敲除使肿瘤细胞对免疫治疗更加敏感
作者下一步研究主要集中在Ptpn2基因。当Ptpn2基因被敲除后GVAX联合PD-1抗体免疫治疗的效果更加明显(图3a,3b);当Ptpn2基因敲除细胞重新正常表达或者过表达Ptpn2会抵抗GVAX联合PD-1抗体的免疫治疗(图3c,3d)。综合所有结果提示Ptpn2基因是肿瘤免疫治疗的潜在靶点。
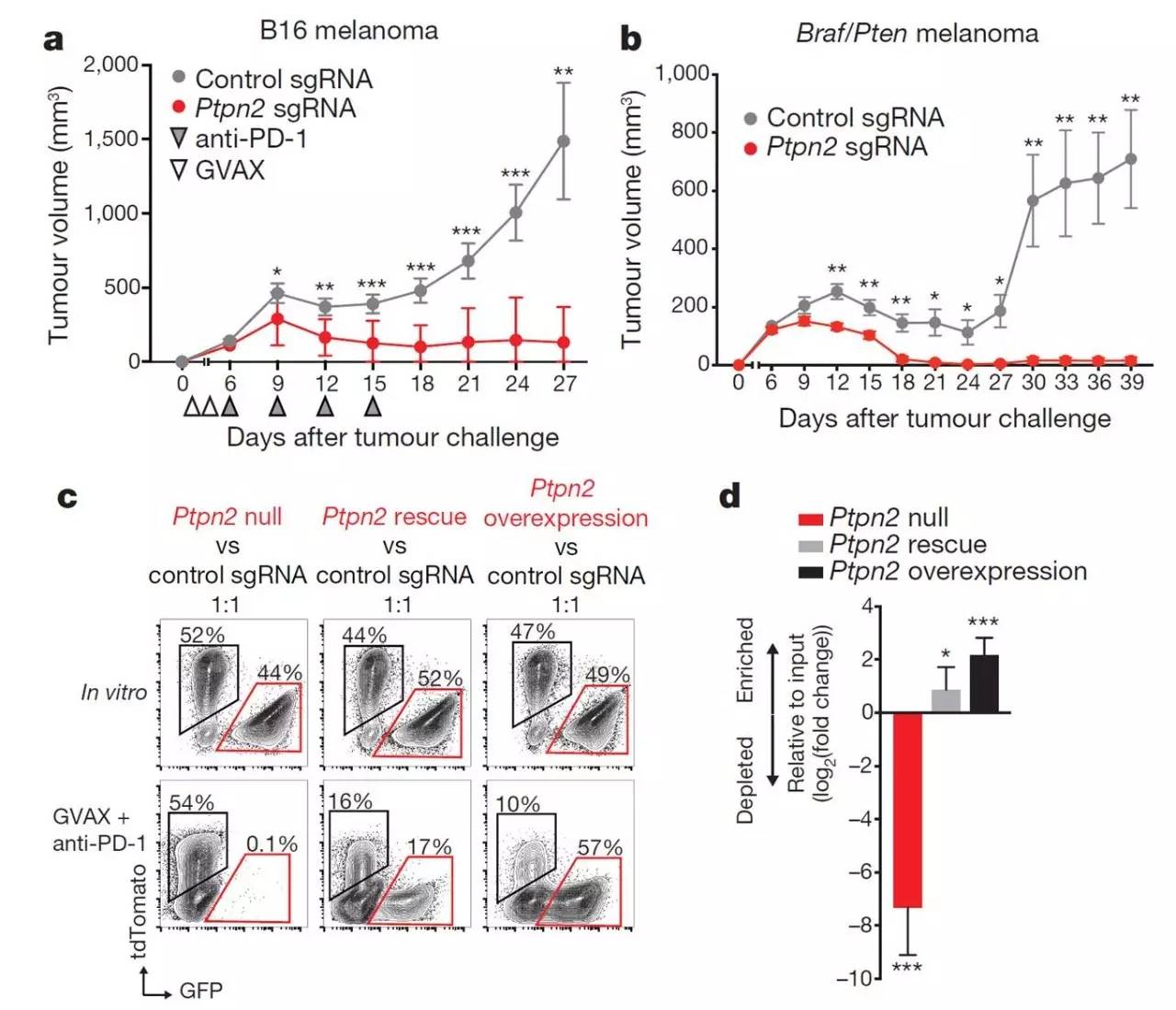
图3 Ptpn2基因敲除使肿瘤细胞对免疫治疗更加敏感
4. Ptpn2基因敲除增加肿瘤抗原提呈
Ptpn2基因敲除可以使肿瘤细胞对免疫治疗更加敏感,那么其潜在的机制是什么呢? 为了找到其机制,作者应用流式技术对Ptpn2基因敲除和对照组肿瘤微环境中的免疫细胞进行分类检测,发现在Ptpn2基因敲除组的微环境中CD8阳性和阳性T细胞明显增多(图4a-4c)。进一步作者在Ptpn2基因敲除组和对照组过表达肿瘤抗原卵清白蛋白(OVA),然后和CD8阳性T细胞共培养,发现Ptpn2基因敲除促进肿瘤细胞抗原提呈和对CD8阳性T细胞毒性的敏感(图4d-4f)。
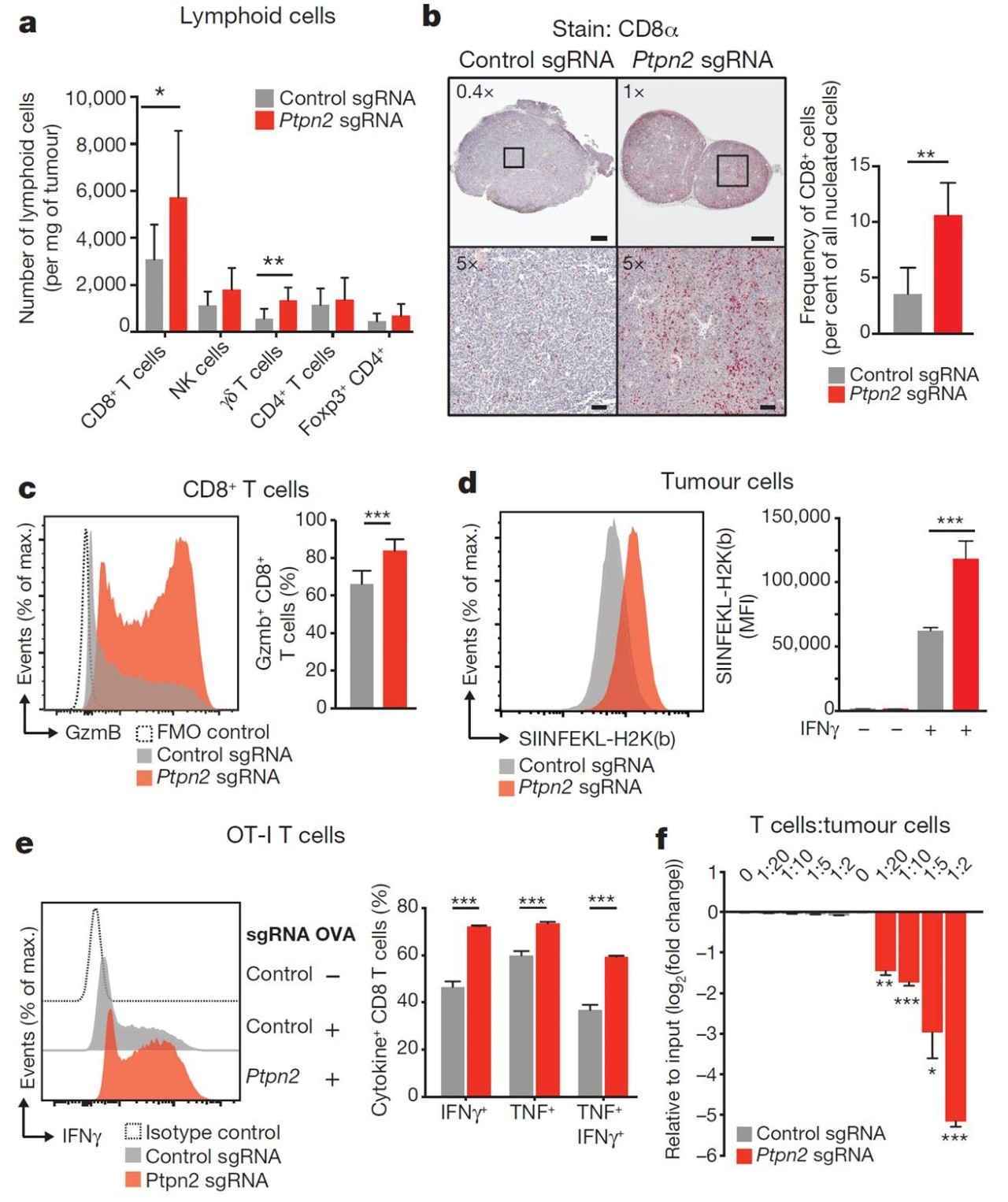
图4 Ptpn2基因敲除增加肿瘤抗原提呈
5. Ptpn2基因敲除使肿瘤细胞对干扰素通路更加敏感
之前的研究发现Ptpn2可以通过抑制JAK1和 STAT1的磷酸化负向调控干扰素信号通路[6,7],那么Ptpn2敲除导致肿瘤细胞对免疫治疗更加敏感是否是通过干扰素信号通路呢?研究发现Ptpn2敲除后STAT1的磷酸化明显增强(图5a),干扰素刺激下干扰素下游基因表达明显升高(图5b,5c)并且肿瘤的增长明显受到抑制(图5d,5e)。
当在Ptpn2基因敲除的肿瘤细胞中同时敲除干扰素的基因Stat1等,明显减弱了由于Ptpn2基因敲除导致肿瘤细胞对免疫治疗的敏感性(图5g,5h)。这些结果提示Ptpn2基因是通过干扰素信号通路调控肿瘤细胞对免疫治疗的敏感性。
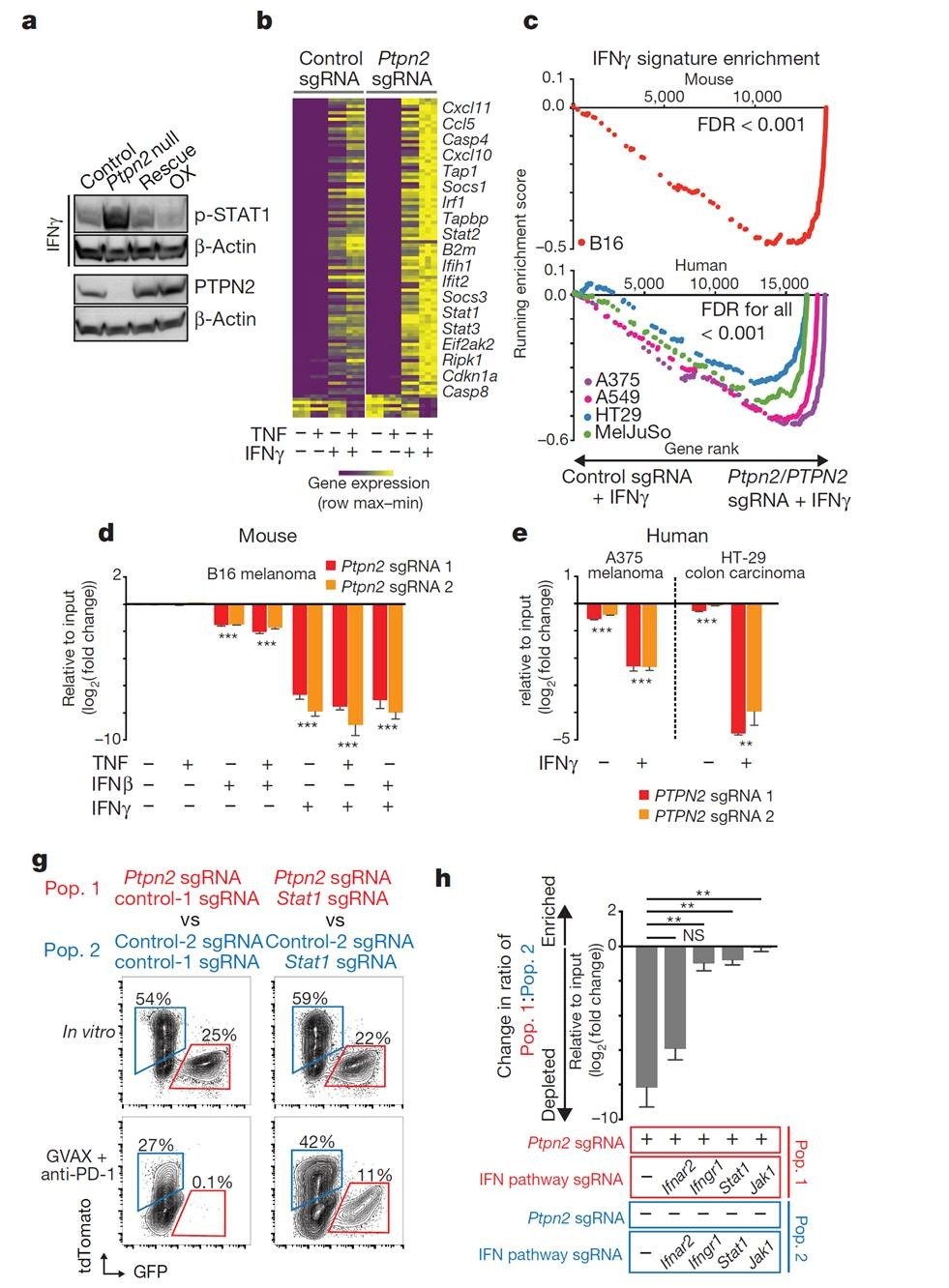
图5 Ptpn2基因敲除使肿瘤细胞对干扰素通路更加敏感
总结与讨论:本研究通过运用CRISPR/Cas9技术,筛选黑色素瘤中了除PD-1/PD-L1和CD47之外新的肿瘤免疫治疗新潜在靶点Ptpn2,为其它肿瘤的肿瘤免疫治疗提供了新的策略和希望。
本研究还筛选到了其它潜在3个基因,其中泛素化-蛋白酶体信号通路Ripk1参与炎症NF-kB信号通路,因此调控Ripk1的水平也成为肿瘤免疫治疗的潜在靶点。
参考文献:[1] Chen, W. et al. Cancer statistics in China, 2015. CA: a cancer journal for clinicians 66, 115-132, doi:10.3322/caac.21338 (2016).
[2] Reck, M. et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. The New England journal of medicine 375, 1823-1833, doi:10.1056/NEJMoa1606774 (2016).
[3] Wolchok, J. D. et al. Nivolumab plus ipilimumab in advanced melanoma. The New England journal of medicine 369, 122-133, doi:10.1056/NEJMoa1302369 (2013).
[4] Zaretsky, J. M. et al. Mutations Associated with Acquired Resistance to PD-1 Blockade in Melanoma. The New England journal of medicine 375, 819-829, doi:10.1056/NEJMoa1604958 (2016).
[5] Manguso, R. T. et al. In vivo CRISPR screening identifies Ptpn2 as a cancer immunotherapy target. Nature, doi:10.1038/nature23270 (2017).
[6] Kleppe, M. et al. PTPN2 negatively regulates oncogenic JAK1 in T-cell acute lymphoblastic leukemia. Blood 117, 7090-7098, doi:10.1182/blood-2010-10-314286 (2011).
[7] Kleppe, M. et al. Deletion of the protein tyrosine phosphatase gene PTPN2 in T-cell acute lymphoblastic leukemia. Nature genetics 42, 530-535, doi:10.1038/ng.587 (2010).
| 序号 | 最新资讯 | 浏览次数 | 作者 | 发布时间 |
| 1 | Nature 突破性发现!肿瘤免疫治疗2.0时代即将到来! | 2999 | 市场部 | 2017-07-30 |
| 2 | 《细胞》子刊:免疫治疗新思路,改造巨噬细胞成为实体瘤杀手,肿瘤缩小80%! | 1943 | 市场部 | 2017-07-30 |